Als Edelmetalle bezeichnet man die sehr beständigen und unreaktiven Metalle wie Gold und Platin. Im Fachjargon sind Edelmetalle die Metalle, deren Redoxpaare im Bezug auf die Normal-Wasserstoffelektrode ein positives Standardpotential haben. Im Rest des Artikels wird es primär darum gehen, was das bedeutet.
Die Standardpotentiale der Elemente sind sehr gut tabelliert und lassen sich sehr einfach nachschlagen. Wenn es also nur darum geht, ob ein bestimmtes Metall ein Edelmetall ist oder nicht, dann empfiehlt sich ein schneller Blick auf die elektrochemische Spannungsreihe. Hat das in fragestehende Metall einen positiven Wert ist es ein edles Metall, ist der Wert negativ ist es ein unedles Metall. Das unedelste Metall ist Lithium, das edelste Gold. Entsprechend sind im direkten Vergleich Metalle mit einem höheren Standardpotential edler als jene mit niedrigerem Standardpotential. Die praktische Anwendung hiervon werden wir noch sehen.

Galvanische Zellen
Um die Definition eines Edelmetalles zu verstehen ist das Verständnis einer „galvanischen Zelle“ unumgänglich. Batterien sind galvanische Zellen, die Erklärung ist also nicht nur für Edelmetalle interessant. An sich besteht eine galvanische Zelle aus sehr wenigen Teilen. Zwei Elektroden genannte Komponenten aus unterschiedlichen Materialien, Metalle für unsere Zwecke, die über einen Leiter miteinander verbunden sind und zwei Elektrolytlösungen, die mit einer Ionenbrücke verbunden sind. Mit Elektrolytlösung ist in diesem Fall konkret eine Flüssigkeit gemeint die Ionen, elektrisch nicht neutrale Atome der Elektrodenmaterialien enthält.
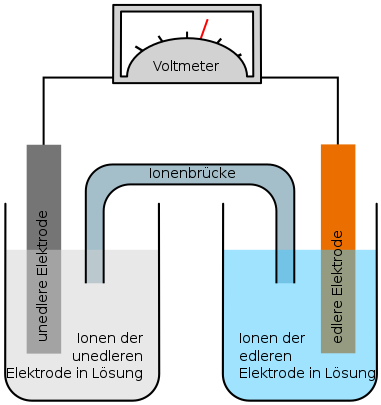
Der Clou einer galvanischen Zelle ist, dass in dem Moment indem die Elektroden gleichzeitig ihre entsprechenden Elektrolytlösung berühren ein Strom fließt. Die gemessene Spannung entspricht unter Standardbedingungen dem Differenzbetrag zwischen den Standardpotentialen der Elektrodenmaterialien.
Stromfluss
Grund dafür ist das unterschiedlich große Bestreben der Elektrodenmaterialien Ionen zu bilden, also Elektronen abzugeben. Generell haben unedlere Metalle eine höhere Tendenz Ionen zu bilden als edlere Metalle. Entsprechend haben die Ionen edlerer Metalle eine höhere Tendenz Elektronen aufzunehmen, als die Ionen unedlerer Metalle. Das äußert sich dadurch, dass sich die unedlere Elektrode in einer galvanischen Zelle beginnt aufzulösen, während die edlere Elektrode zu wachsen scheint.

Was also passiert ist Folgendes: Im Kontakt mit der Elektrolytlösung geben die Atome der unedleren Elektrode, die sogenannte Anode, Elektronen ab und wandern dann als Ionen in die Lösung. Die abgegebenen Elektronen wandern durch den Leiter zur edleren Elektrode, der sogenannten Kathode. Hier kommt dann die Elektrolytlösung ins Spiel, die voll von Ionen des edleren Metalls ist. Die Ionen verbinden sich mit den ganzen zusätzlichen Elektronen in der Elektrode und bilden Atome. Diese lagern sich an der Anode an, die dadurch wächst.
Die wandernden Elektronen sind das, was als Strom gemessen wird, dafür sind allerdings zwei Faktoren sehr wichtig. Der erste ist, dass der Prozess der Elektronenabgabe durch Atome der unedlen Metalle und die Elektronenaufnahme durch Ionen der edlen Metalle von einander getrennt sein müssen. Der zweite Faktor ist die Ionenbrücke, sie stellt sicher, dass ein geschlossener Stromkreis vorliegt. Als Reaktion auf den Fluss negativ geladener Elektronen durch den Leiter fließen negativ geladene Ionen durch die Ionenbrücke.
Eine sehr anschauliche Animation dieses Prozesses findet ihr hier: http://www.chempage.de/theorie/galvanisches%20element.html
Referenz
Da nur Strom fließt oder eine Spannung gemessen werden kann, wenn zwei unterschiedliche Elektroden genutzt werden, benötigt man für die Charakterisierung einer Halbzelle (eine der beiden Elektroden in ihrer entsprechenden Elektrolytlösung) immer einen Vergleich bzw. eine zweite Halbzelle. Obendrein ist die gemessene Spannung auch noch vom Referenzmaterial abhängig.
Reproduzierbarkeit ist in den Wissenschaften das A und O. Entsprechend wichtig ist es immer eine gemeinsame Definition für Alles mögliche zu finden. Entsprechend hat man sich auf eine Referenzelektrode geeinigt, namentlich die Wasserstoff-Elektrode. Für die Wasserstoff-Elektrode bedeutet das, dass ihr Standardpotential willkürlich auf 0 V gesetzt wurde. Die Standardpotentiale aller anderen Elemente ist entsprechend schlicht die Spannung, die in einer galvanischen Zelle gemessen wird, wenn die zweite Halbzelle die Wasserstoff-Elektrode unter bestimmten Bedingungen ist.
Zusammenfassung
Was man aus diesem Text mitnehmen sollte ist folgendes: Edelmetalle sind naturwissenschaftlich definiert. Ihre Definition bezieht sich auf eine galvanische Zelle. Genauer die Interaktion ihrer Halbzelle mit der Wasserstoff-Elektrode unter Standardbedingungen. Baut man eine galvanische Zelle mit der Wasserstoff-Halbzelle als Elektrode und die andere Elektrode aus einem anderen Material, dann wächst die Elektrode von Edelmetallen, während sich die Elektroden von unedlen Metallen zersetzen. Weil das nicht jeder einfach so machen kann, gibt es die elektrochemische Spannungsreihe zum Nachschlagen der Standardpotentiale. Ist das Standardpotential positiv handelt es sich um ein Edelmetall, ist es negativ reden wir von einem unedlen Metall und wenn es null ist, dann haben wir Wasserstoff.
Abschließend ein paar Links zu Quellen und weiterführenden Texten zu diesem Thema: Link 1, Link 2, Link 3, Link 4.