Luminol ist die Subtanz, die in Gegenwart von Blut mit Wasserstoffperoxid (H2O2) unter Ausstrahlung von hellblauem Licht reagiert. Chemisch ist es eine organische Substanz mit der Summenformel C8H7N3O2 und dem sperrigen Namen 5-Amino-2,3-dihydrophthalazine-1,4-dion. Die Verbindung wurde 1902 von Aloys Josef Schmitz zum ersten Mal hergestellt. Herbert Otto Albrecht befasste sich 1928 als erster mit der Leuchtreaktion des Luminols und ihren aktuell geläufigen Namen erhielt die Substanz schließlich 1934 von Ernest Huntress und seinen Kollegen.
Die Reaktion
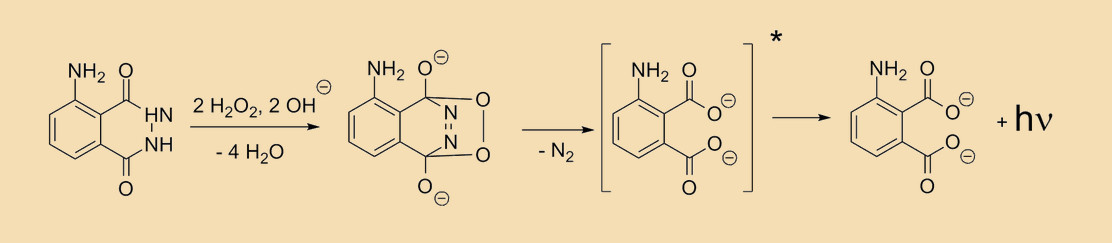
In Fachkreisen spricht man von Chemolumineszenz, wenn die überschüssige Energie einer chemischen Reaktion in Form von Licht abgestrahlt wird. Die berüchtigte Luminol-Reaktion ist eines der bekanntesten Beispiele dafür. Obwohl Luminol hauptsächlich dafür berühmt ist Blut zum leuchten zu bringen, hat Blut mit der eigentlichen Reaktion gar nichts zu tun. Tatsächlich reagiert das Luminol nicht mit Blut, sondern mit Wasserstoffperoxid in einer alkalischen Umgebung. Also gelöst in einer Lösung mit einem pH-Wert größer als 7.
Das Leuchten
Mehr noch, der Lichtproduzent ist nicht die eigentliche Reaktion, sondern deren Produkt. Die genaue Erklärung geht sehr in chemische Details, es würden Ausdrücke wie „elektronischer Singulett- und Triplettzustand“ fallen und am Ende wären alle beteiligten zunächst hauptsächlich verwirrt. Stattdessen stellen wir einfach fest, dass das direkte Reaktionsprodukt in einem ungünstigen Zustand vorliegt. Es existiert eine stabilere Version desselben Moleküls und um diesen Zustand zu erreichen, muss das Molekül Energie abgeben. Wer bis hierhin aufgepasst hat kann sich wahrscheinlich sogar schon denken wie diese Energie abgegeben wird. In der Form hellblauen Lichts.
Das Blut
Das Ding ist, dass die Reaktion recht langsam ist. Sie passiert nicht oft genug, um eine sichtbare Menge Licht zu produzieren. Hier kommt dann das Blut ins Spiel, genau genommen nur ein einziges Atom im Blut, nämlich das Eisen. Optisch ist es für die rote Farbe des Blutes verantwortlich, biologisch für den Sauerstofftransport und chemisch für das sichtbare blaue Leuchten der Luminol-Reaktion.
Das Eisen-Atom ist ein Katalysator. Also eine Substanz, die eine Reaktion beschleunigt, aber am Ende noch genauso vorliegt, wie am Anfang. Er wird also nicht verbraucht. In Gegenwart von Blut passiert die Reaktion also öfter und in der Konsequenz wird soviel Licht erzeugt, dass man es auch mit bloßem Auge sehen kann.
Anwendungsprobleme
Die Anwendung von Luminol ist allerdings nicht immer so problemlos, wie in manchen Medien dargestellt. Zunächst einmal reicht auch eine Kleinstmenge Eisen, um die Luminol-Reaktion zu katalysieren. Da in quasi allen Körperflüssigkeiten Spuren von Blut enthalten sind, erzeugt zum Beispiel auch Urin fast immer das hellblaue Leuchten. Natürlich leuchten auch andere Eisen enthaltende Substanzen, wenn man sie mit Luminol besprüht. Auch Kupfer kann in manchen Fällen das blaue Leuchten hervorrufen und sogar einige Bleichmittel und Meerrettich.
Da das Blut nur als Katalysator dient, kann es auch nach der Identifikation durch Luminol analysiert werden. Allerdings sind nicht alle möglichen Beweismittel so resistent wie Blut. Das Reaktionsgemisch wird praktisch also eher lokal und geplant eingesetzt, anstatt einen Raum einfach einmal komplett in ihm zu tränken.
Die geschichtlichen Eckdaten stammen von Wikipedia. Details über die Reaktion stammen von der Universität Jena und Chemistryworld.com.